¿Cómo construyo una célula galvánica para depositar metales?
Una célula galvánica para depositar metales, también conocida como célula electrolítica o célula galvánica, es un dispositivo utilizado para depositar una capa de metal sobre otro metal mediante un proceso electroquímico. Aquí tienes una guía paso a paso para construir una célula de este tipo:
Materiales:
- Alimentación de corriente: Una alimentación de corriente continua controlable.
- Ánodo: Por ejemplo, un ánodo de cobre si se va a depositar cobre, para algunas soluciones también se debe utilizar un ánodo diferente - sigue las instrucciones del electrolito.
- Cátodo (pieza): La pieza de metal sobre la que se va a depositar el otro metal (por ejemplo, una joya).
- Solución electrolítica: Solución que contiene iones metálicos del metal que se va a depositar (por ejemplo, electrolito de cobre para la deposición de cobre).
- Recipiente: Para contener la solución electrolítica.
- Cables y pinzas de cocodrilo: Para conectar los electrodos a la fuente de alimentación.
Preparación:
-
Preparación de la solución electrolítica:
- Llena el recipiente con la solución electrolítica. Puedes utilizar un electrolito de cobre, por ejemplo, para depositar cobre.
- Llena el recipiente con la solución electrolítica. Puedes utilizar un electrolito de cobre, por ejemplo, para depositar cobre.
-
Inserción de los electrodos:
-
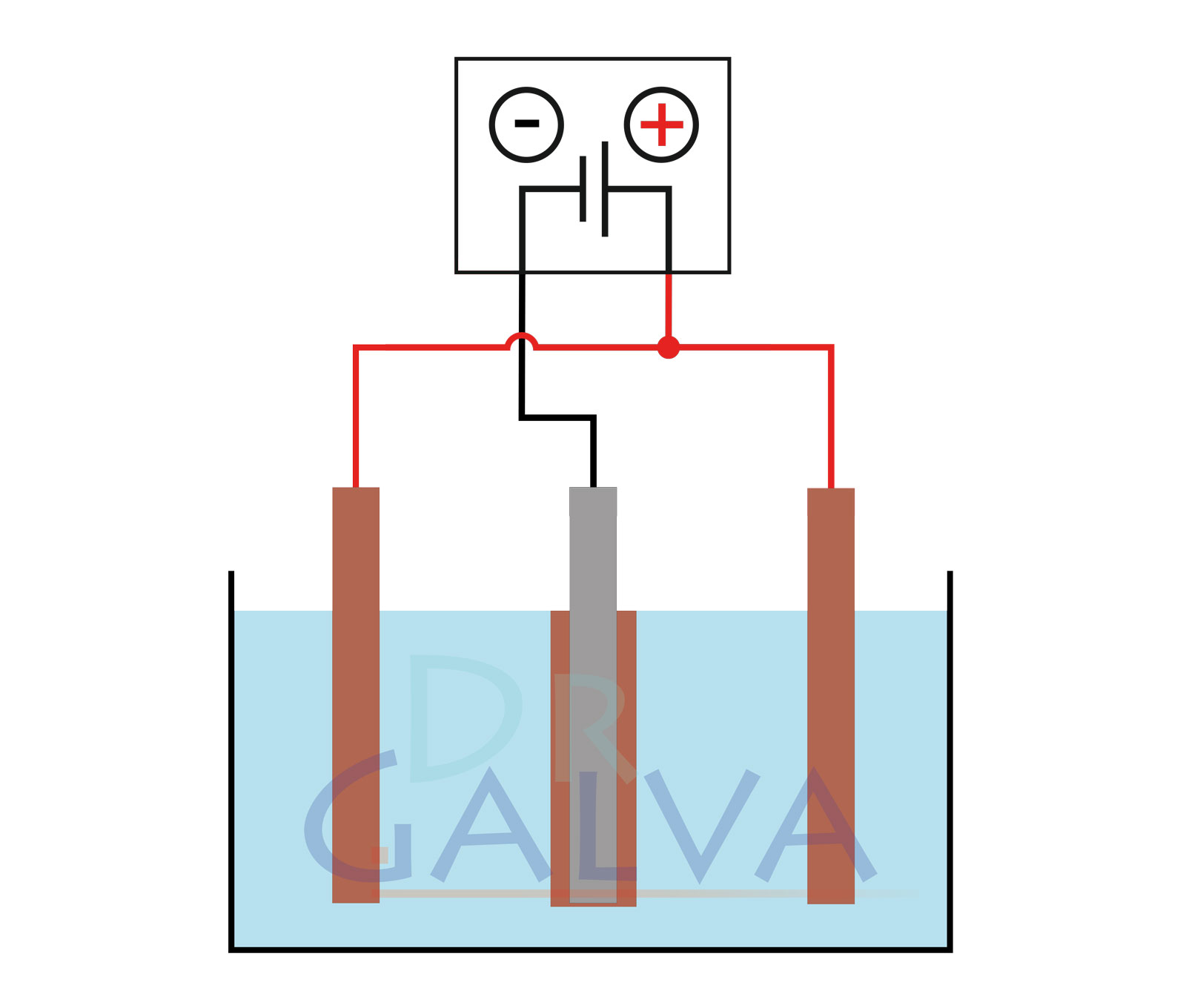
Ánodo: Introduce los ánodos (por ejemplo, la placa de cobre) en la solución. Estos electrodos proporcionarán el metal a depositar. Deben utilizarse dos ánodos opuestos para conseguir una deposición más uniforme. Consulta los diagramas. (Si no es posible lograr esta disposición de los ánodos, se puede conseguir un recubrimiento uniforme de la pieza mediante rotación continua).
Consulta también el apartado "Dispersión en galvanotecnia" -
Cátodo: Coloca también el cátodo (por ejemplo, la pieza de joyería) en la solución. Es la pieza sobre la que se deposita el metal.
-
Ánodo: Introduce los ánodos (por ejemplo, la placa de cobre) en la solución. Estos electrodos proporcionarán el metal a depositar. Deben utilizarse dos ánodos opuestos para conseguir una deposición más uniforme. Consulta los diagramas. (Si no es posible lograr esta disposición de los ánodos, se puede conseguir un recubrimiento uniforme de la pieza mediante rotación continua).
-
Conexión a la fuente de alimentación:
- Conecta el ánodo (placa de cobre) al polo positivo de la fuente de alimentación.
- Conecta el cátodo (pieza) al polo negativo de la fuente de energía. Esto hace que el cátodo se cargue negativamente, lo que provoca que el metal se deposite sobre él.
-
Conecta el flujo de corriente:
-
- Enciende la fuente de corriente. Los iones metálicos de la solución (por ejemplo, iones de Cu²⁺) son atraídos por el cátodo, ya que está cargado negativamente. Los iones se reducen a átomos metálicos neutros y se depositan en la superficie del cátodo.
Cómo funciona:
- Ánodo (placa de cobre): El ánodo se disuelve parcialmente debido al flujo de corriente, liberando iones de cobre (Cu²⁺) en la solución, por lo que la concentración de iones de cobre en la solución electrolítica permanece constante:
Cu → Cu²⁺ + 2e⁻
- Cátodo (pieza): En el cátodo, los iones de cobre (Cu²⁺) de la solución son reducidos por los electrones y depositados en la pieza como cobre metálico:
Cu²⁺ + 2e⁻ → Cu
Notas importantes:
- Amperajey tiempo: El amperaje y la duración del proceso determinan el grosor de la capa metálica depositada. Las corrientes más altas y los tiempos más largos dan lugar a capas más gruesas.
- Temperatura: La temperatura de la solución electrolítica puede influir en la velocidad de deposición. Las temperaturas más altas pueden acelerar el proceso, pero también influyen en la calidad de la capa.
- Pureza de la solución electrolítica: Las impurezas de la solución pueden afectar a la calidad de la capa metálica depositada.
Resultado:
Con esta configuración se deposita una capa metálica uniforme sobre la pieza. Éste es el principio básico de la galvanización, que se utiliza en muchos procesos industriales para recubrir metales y proteger o refinar superficies.
Estructura general:
Comparación de la deposición:
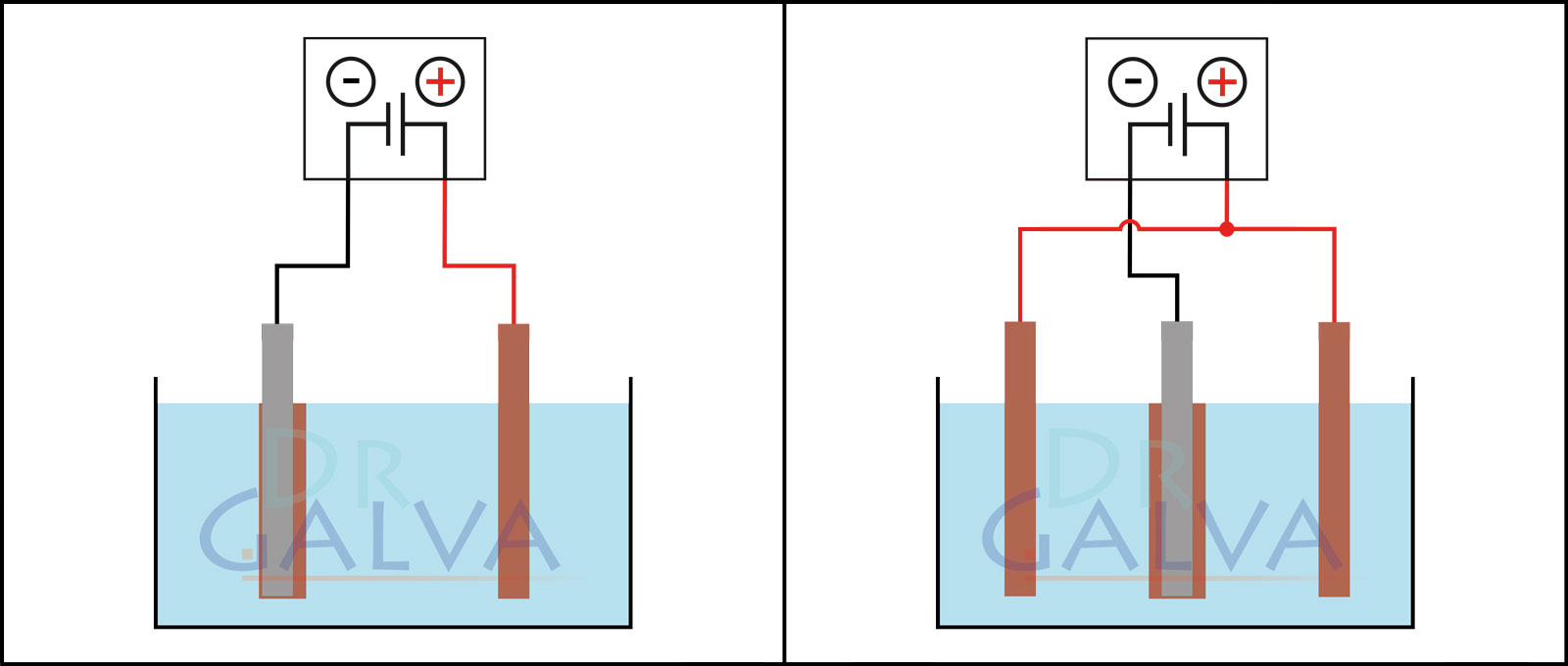
| El ánodo y la pieza se colocan uno frente al otro. Se deposita más metal en la parte delantera de la pieza que en la trasera. La pieza debe girarse a intervalos regulares. | En el depósito se encuentran dos ánodos y la pieza de trabajo. Hay que tener en cuenta que ambos ánodos deben estar conectados a la misma fuente de alimentación. La pieza se coloca en el centro entre los dos ánodos. Esto garantiza una deposición más uniforme. |



























